精神科医のためのセロトニントピックス ~不安症、うつ病、トラウマとの関連性~(前編) 精神医学クローズアップ Vol.14
精神疾患とセロトニンの関係性は強く、特に不安症、うつ病、トラウマとの関連性について多くの知見が蓄積されています。本稿では、精神科医として臨床に携わる傍ら、情動とセロトニンとの関係について先駆的な研究を一緒に行ってこられた井上猛先生、泉剛先生に、セロトニンと精神疾患に関するトピックについてお話を伺いました。
前編では、「セロトニンと不安」にフォーカスを当てます。不安・恐怖に関連する脳内神経回路(fear network)やセロトニン神経系、セロトニン(5-HT)受容体の役割などについて、広く深い視野でのご見解をお話しいただきました。
井上 猛 先生
(東京医科大学メンタルヘルス科(精神医学分野) 主任教授)
泉 剛 先生
(北海道医療大学薬学部薬理学講座臨床薬理毒理学 教授)
前編 精神疾患における不安とセロトニン
―はじめに、両先生のご関係について簡単に教えてください。
泉 井上先生と私が所属していた北海道大学で、小山司名誉教授のご指導のもと、セロトニンと不安の研究を一緒に進めてきました。
井上 私が先行して研究していましたが、それを大きく発展させてくださったのが泉先生です。泉先生は現役の精神科医であると同時に、薬学部の教授を務めていらっしゃいます。全国的にも稀有な存在で、精神薬理にかかわる博識から学ぶことはとても多いです。
「一概に不安といっても、精神疾患によってその本質は異なります」(井上先生)
―井上先生、臨床的観点からみた精神疾患と不安症状について教えてください。
井上 不安は、精神疾患でさまざまな表現型があります。実臨床では、不安の本質を見極めることが重要です。
例えば、不安症群のパニック症では「死ぬのではないか」という不安(死ぬことに対する恐怖)が襲ってきますが、これは「生存したい」気持ちが根底にあると考えます。一方、不安(不安性の苦痛)を伴うつ病は、自殺念慮などの「死にたい」気持ちが強くなります1。これだけでも、うつ病での不安と不安症群の不安との差は明らかです。
随伴症状も異なります。パニック症であれば、不安発作時以外は元気に過ごせますが、うつ病では意欲低下や易疲労性、興味・喜びの低下など、さまざまな症状を認めます1。
治療の面についても、パニック症であればセロトニン再取り込み阻害薬(SSRI)や、必要に応じてベンゾジアゼピン系抗不安薬(BZ)を併用し2、不安(不安性の苦痛)を伴ううつ病の場合はそのほかの選択肢も考えられます3-6。
―泉先生、不安の基礎研究について教えていただけますか。
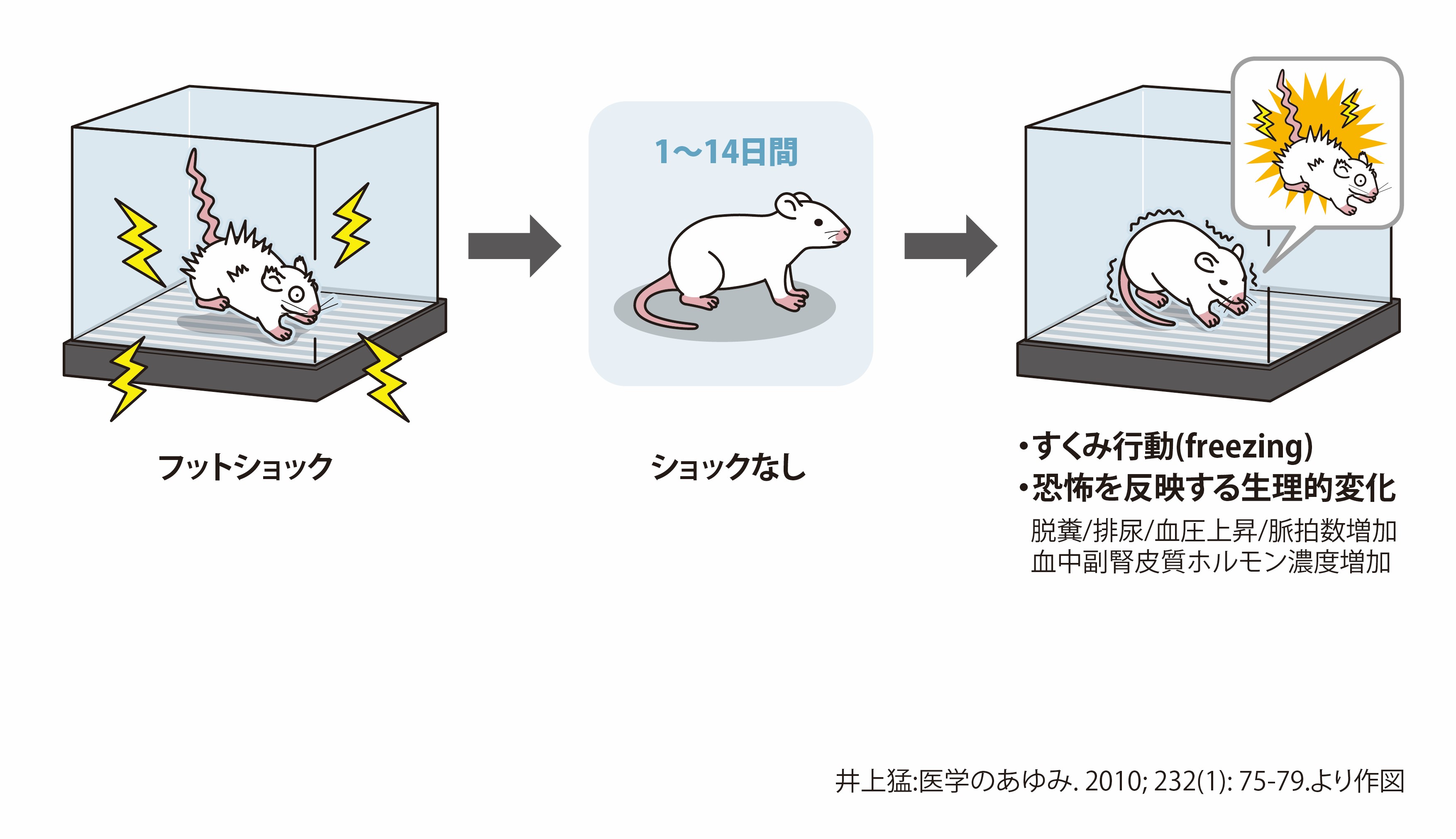
泉 不安の生物学的機序は、動物モデルから進展しました。動物モデルの中でも「恐怖条件付けモデル」(図1)7が不安に関する脳神経回路の研究を牽引していますが、井上先生はこのモデルで研究を積み重ねられており、今振り返っても慧眼だったと思います。
このモデルでは、「すくみ行動(freezing)」という人間と同様の恐怖行動によって不安の有無を判定します。また、人間と同じように、SSRIやBZでこの恐怖行動が抑えられることが報告されていますが、世界で初めてSSRIと恐怖行動や不安との関係を動物実験で示したのが井上先生です。8,9。
図1 恐怖条件付けモデル
ショック箱の中にラットを入れ電撃によるフットショックを与える。1~14日後に再びショック箱に入れると、フットショックがなくてもすくみ行動(freezing)や恐怖を反映する生理的変化が起きる。
―不安の生物学的機序について、現在どのようなことが分かっているのでしょうか。
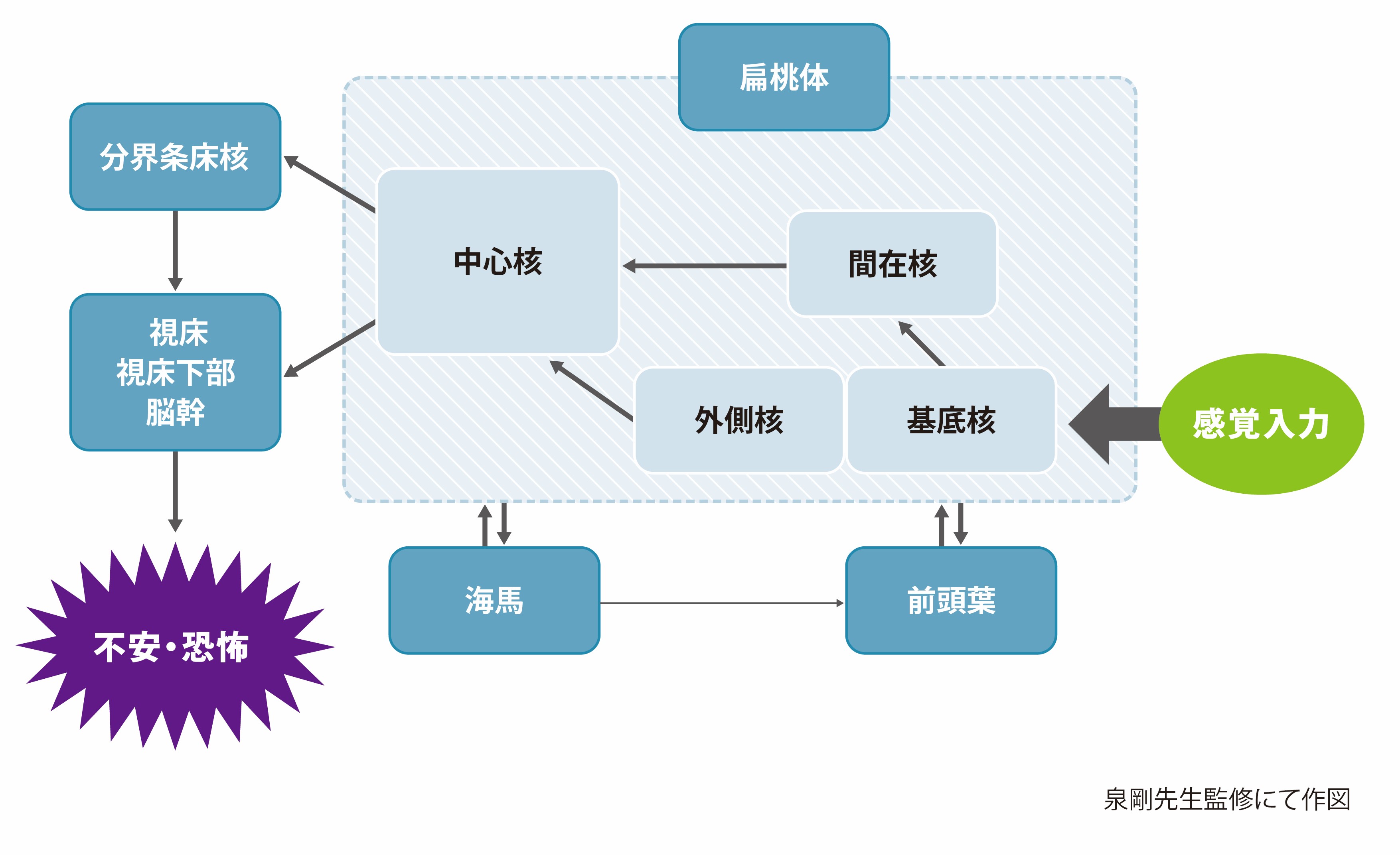
泉 現在、不安・恐怖に関連する脳内神経回路(fear network)という概念で捉えるのが一般的です(図2)10,11。fear networkは前頭葉、扁桃体、海馬に加え、最近注目されている分界条床核が関係しており、これらのfear networkにセロトニンを含むモノアミン神経系が投射され、不安の調節を行っていると考えられています10。
Fear networkの中心は扁桃体です10,11。動物の扁桃体を両側性に破壊すると、その動物は不安を示さなくなります12。ヒトでも偶発的な損傷などによって両側の扁桃体の機能が失われると、同様の状態になるとされています12,13。
ヒトや動物の研究結果から、扁桃体の中でも基底外側核(基底核と外側核)が不安と強い関係にあることが分かっています(図2)10。不安の情報は基底外側核から中心核に、さらに分界条床核に出力されます。分界条床核から視床、視床下部、脳幹と出力され、不安/恐怖反応が発現すると考えられています10。
Fear networkの調節を行っているのが前頭葉、海馬です(図2)10。前頭葉は基底外側核に対する抑制作用が示唆されています10。海馬は一般に記憶を司る部位として知られており、図1の恐怖条件付けでは場所、状況などの記憶が関係します14。記憶が関係しない即時的な恐怖や不安だと海馬を破壊しても発現すること、すなわち扁桃体が存在すれば起こることが分かってきました13,15,16。
図2 不安・恐怖に関連する脳内神経回路(fear network)
―脳部位のお話を伺いましたが、不安に対する脳機能画像の知見も蓄積されているのでしょうか。
泉 不安に関する脳機能画像検査は膨大な研究がありますが、矛盾する所見が多く、まだはっきりした知見を述べることは難しいですね。不安症、パニック症、社交不安症、心的外傷後ストレス障害(PTSD)の脳では扁桃体を中心とするfear networkを構成する脳部位が活性化していることが報告されていますが10、各疾患特有の特徴などを述べるまでには至っていないのが現状です。なお、強迫症では前帯状皮質/眼窩前頭皮質-線条体のネットワークが関与しているという報告があります17。
―セロトニンを含むモノアミン神経系と不安との関係性について教えてください。
泉 精神薬理学の観点から研究が進み、特にノルアドレナリン、セロトニンとの関連性が分かってきました10,18,19。
古くから、ノルアドレナリンは恐怖・不安を亢進させることが知られています19。セロトニンは不安を調節することが分かっていましたが、その端緒はセロトニン再取り込み阻害作用を有する三環系抗うつ薬が抗不安作用を示したことでした10,18。セロトニン・ノルアドレナリン再取り込み阻害薬にも抗不安作用はあるのですが、選択的なノルアドレナリン再取り込み阻害薬では抗不安作用が示されず、不安の調節で主要な役割を担うのがセロトニンであることが示唆されました10,18。
ただ、ノルアドレナリンは「活性化すれば不安が亢進される」というシンプルな機序ですが、セロトニン神経系は単純ではありません。セロトニン神経系の活性化/抑制、セロトニンの増加/減少で不安症状の変化が一定せず、ずっと論争が続いてきました。
「セロトニンのふるまいは複雑ですが、セロトニン神経系の機序をさらに複雑にしているのが受容体です」(泉先生)
―セロトニン受容体との関連性についてはいかがでしょうか。
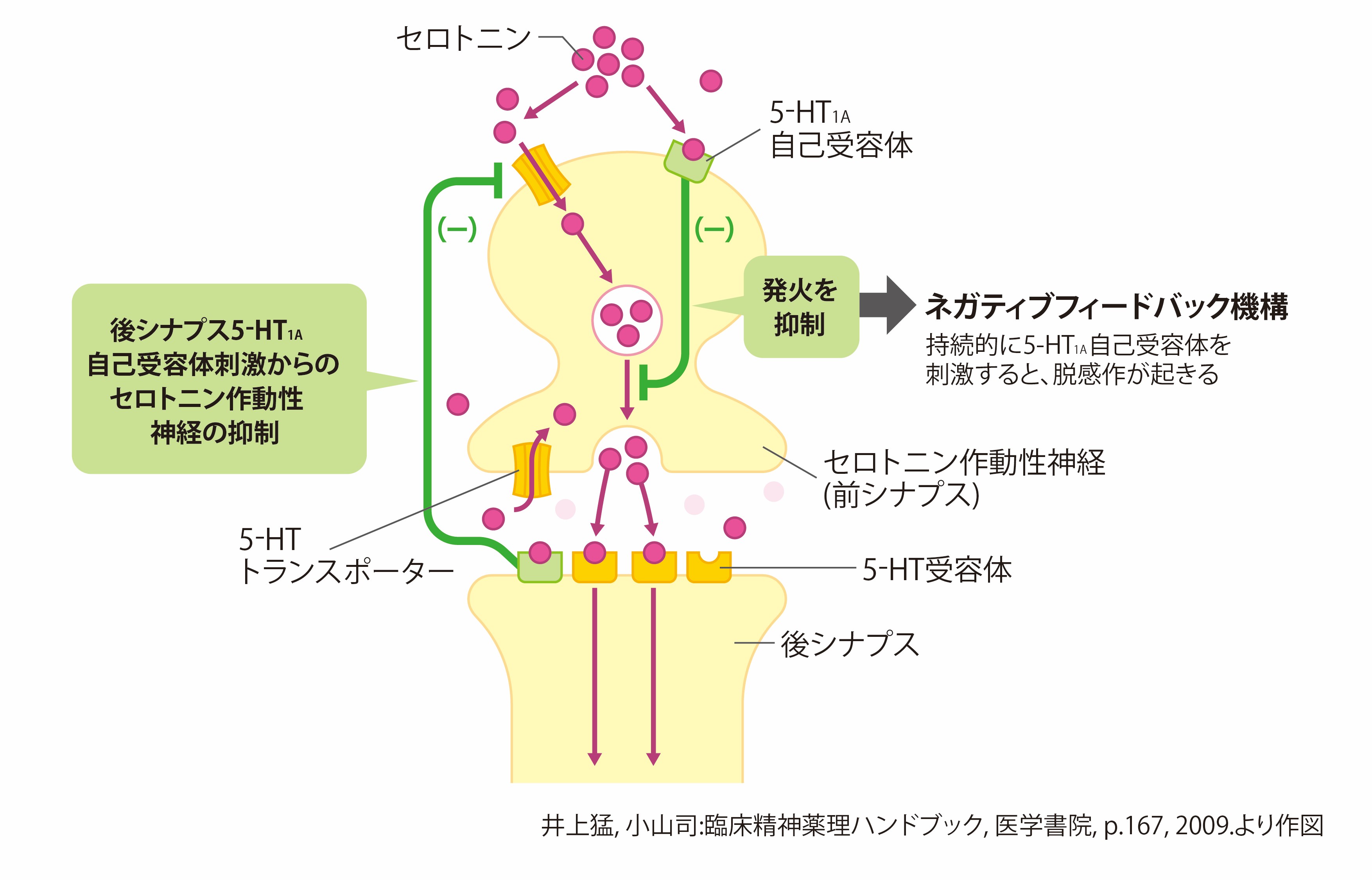
泉 セロトニン作動性神経の起始核である縫線核は、中脳から脳幹の内側部に分布する細胞集団で、セロトニン(5-HT)1A自己受容体があります。自己受容体ではセロトニンによる刺激を受けると、セロトニン作動性神経の発火を抑制するように作用します。これがネガティブフィードバック機構です(図3)18。この機構が判明した当時、セロトニン再取り込み作用でセロトニンが増えると5-HT1A自己受容体を刺激し、ネガティブフィードバックが起こることから、放出されるセロトニンが減少することで抗不安作用を示すというメカニズムが考えられ、セロトニンは不安を亢進させるという意見が優勢でした。
図3 セロトニン作動性神経に対するネガティブフィードバック機構
次に、セロトニン再取り込みを阻害した場合を考えますと、セロトニンは脳内で増加します。前述の通り、5-HT1A自己受容体が刺激され縫線核からの投射・放出が抑制されることも考えられますが、それよりも「セロトニンが増えることで抗不安作用が誘発されると考えた方が自然」とする意見が強まりました。
このように、セロトニンの“ふるまい”が複雑だと分かりますが、セロトニン神経系の機序をさらに複雑にさせているのは受容体です。不安との関連が深い受容体として5-HT1A、5-HT2A、5-HT2C、5-HT3などが考えられていますが、脳機能画像検査でも5-HT受容体のサブタイプごとの違いは明らかになっていません。今後、受容体に特異的なリガンドが発見されれば、研究が進むかもしれません。
「一部の5-HT受容体を遮断する物質が不安に作用する可能性があることは、創薬に有益な情報となり得ます」(井上先生)
―基礎研究から得られた知見は、どのように臨床に役立てることができますか。
井上 泉先生のお話から、不安の発現には脳部位、セロトニン神経系と投射経路、5-HT受容体などが複雑に関与していることが分かりましたが、これらの内容は不安に対する治療を考えていくうえで重要な知見になると考えます。動物実験の基礎研究とヒトでの臨床は直接つなげられず、あくまで参考になりますが、5-HT受容体については、5-HT2c, 5-HT 3受容体を遮断する物質が不安を減弱する可能性があることを念頭に置きたいところです10,18。創薬研究でも有益な情報になると思われます。
泉 セロトニン再取り込み阻害作用と5-HT3受容体遮断作用のある物質があれば、セロトニン増加に伴って起こりうる嘔吐を抑えられますし、抗不安作用も期待できます10,18,20,21。
井上 セロトニン再取り込み阻害と5-HT3受容体拮抗を同時に作用させることによる、精神薬理に基づいた結果をきちんと検討・確認したいですね。
加えて、不安症に対するSSRIであっても、全例に有効性が認められるわけではありません。海外のガイドライン2,22でも、SSRI/SNRI(本邦では保険適用外)以外の治療は認知行動療法、精神療法などに留まっており、アンメットニーズといえます。基礎研究の知見は、目の前の患者さんに少しでも有効な治療薬を届けたり、治療に反応しない患者さんの薬剤をスイッチしたりする際の参考になると思います。
また先ほど、泉先生が脳機能画像検査に関する知見をPTSDも含めてお話しされていましたが、PTSDは心身外傷(トラウマ)、恐怖記憶と関係しているので、海馬が大きな役割を果たしているのではないかと推測します。
泉 PTSDの動物実験では、問題となる記憶を消す「恐怖条件付けの消去」といわれる現象も盛んに研究されています。恐怖条件付けモデル(図1)を例にすれば、電撃によるフットショックを受けて次の日にすくみ行動が現れても、箱に入ってショックを受けない状況が繰り返されるとすくみ行動が減るというものです。
私たちの研究で、扁桃体に投射するセロトニン作動性神経を破壊すると恐怖条件付けの消去時間が早まることを報告しました23。また、5-HT1A受容体作動薬の投与でも文脈的な学習(恐怖条件付けの元となる学習メカニズム)が抑制されましたが、この作用は5-HT7受容体刺激で打ち消されることや24、5-HT7受容体遮断に加え、NMDA受容体部分作動薬が消去を早めることも報告されています25,26。これらの結果は、消去を一種の学習だと捉えたうえで、学習・記憶を促進する操作により記憶(トラウマ)の消去が早まることを示唆しています。
「現在、セロトニン受容体のサブタイプに注目し、研究を行っています」(泉先生)
―セロトニン研究は、今後どのような点が注目されるでしょうか。
泉 まず、サイケデリックス(幻覚剤)です。一部の薬剤がPTSDに効果を示すことが報告されており、薬理的には5-HT2A受容体へのアゴニスト作用ではないかと考えられています10, 27。5-HT2A受容体については、2023年に、皮質にあるニューロンの細胞内(特にゴルジ体)に大量にプールされていることが報告されました28。一般に脂溶性の高い物質は細胞膜を通過しますが、幻覚剤が誘発する神経可塑性には膜透過性が必要、かつ細胞内5-HT2A受容体を介したシグナル伝達の関与も示唆されました28。5-HT2A受容体とうつ病、不安との解明がなされれば創薬につながると思います。
次に、5-HT7受容体です。この受容体は、縫線核の細胞体にある5-HT1A受容体と二量体を形成していることが報告されました29。5-HT1A受容体は前シナプス、後シナプスに存在しますが、脱感作を起こすのは前シナプスの5-HT1A受容体だけで、その機序が不明でした。それが、この発見により二量体が関係している可能性が出てきたと考えています。
私は今、セロトニン受容体がどの神経細胞上に発現しているか、北海道大学解剖発生学分野の今野幸太郎先生と共同研究を行っていますが、セロトニン受容体(5-HT1A,2A,3受容体)がそれぞれ特定のGABA作動性神経上にあることが分かってきました30。つまり、セロトニン受容体のサブタイプがGABA作動性神経の異なるネットワークに作用している可能性を示唆しています。
井上 泉先生のお話ですと、セロトニン神経系の下流にGABAがある、つまりセロトニン作用の最終的なアウトプットがGABAかもしれないということですね。薬理的に面白いテーマだと思いました。臨床で、GABA系に直接作用させる薬剤だと即効性が認められるが長期的な副作用でさまざまな懸念がある点、セロトニン神経系への作用だと臨床的な効果発現に時間がかかる点も説明できるかもしれないですね。
精神薬理学や脳科学を突き詰めることで、個別化医療とまではいかないまでも、将来的に「トラウマを有する患者さんにはこの治療」といった、より良い治療選択肢が見つかることを期待します。

<プロフィール>
井上 猛 先生
東京医科大学 メンタルヘルス科(精神医学分野) 主任教授
東京医科大学病院 認知症疾患医療センター 副センター長
1984年北海道大学医学部卒業。北海道大学医学部附属病院精神科、市立小樽第二病院精神科を経て、1987年に北海道大学医学部精神医学分野に帰局し、助手、講師、准教授を務める。1995~6年に米国ウィスコンシン大学マジソン校精神医学教室留学。2015年 5月より現職。専門はストレスの臨床・動物実験研究、SSRIの精神薬理などで、日本の精神医学におけるストレス研究をリードしている。
泉 剛 先生
北海道医療大学 薬学部薬理学講座(臨床薬理毒理学分野) 教授
1990年北海道大学医学部卒業。北海道大学大学院医学研究科精神医学分野および関連病院で不安障害と感情障害の臨床に従事しながら、恐怖条件付けストレスモデルによる不安の実験的研究を行う。2006年に同大神経薬理学分野へ移り、不安の脳内メカニズム、SSRIの作用機序、幼若期ストレス、うつ病の動物モデル等の研究を行う。2013~4年に米国アルバート・アインシュタイン医科大学精神科留学。帰国後、神経薬理学分野の准教授を務めた後、2017年より現職。
取材/撮影:ルンドベック・ジャパン Progress in Mind Japan RC
取材日:2024年3月15日
取材場所:ルンドベック・ジャパン(東京都港区)
Progress in Mind Japan Resource Centerは、会員の皆様が安心して自由に意見交換できる場を提供することを目指しています。
本コンテンツに登場する先生方には、Progress in Mind Japan Resource CenterのWebコンテンツ用の取材であることを事前にご承諾いただいたうえで、弊社が事前に用意したテーマに沿ってご意見・ご見解を自由にお話しいただき、可能な限りそのまま掲載しています。
お話の内容は、すべての患者様や医療従事者に当てはまるものではなく、またそれらの内容は弊社の公式見解として保証するものではありません。